Флуарэсцэнтны рэзанансны перанос энергіі (FRET)
Флуарэсцэнтны рэзанансны перанос энергіі (FRET) - гэта працэс невыпраменьвальнай перадачы энергіі, пры якім энергія ўзбуджанага стану донара перадаецца ва ўзбуджаны стан акцэптара праз узаемадзеянне міжмалекулярных электрычных пар.У гэтым працэсе не ўдзельнічаюць фатоны, і таму ён не з'яўляецца радыяцыйным.Гэты аналіз мае такія перавагі, што ён хуткі, адчувальны і просты.
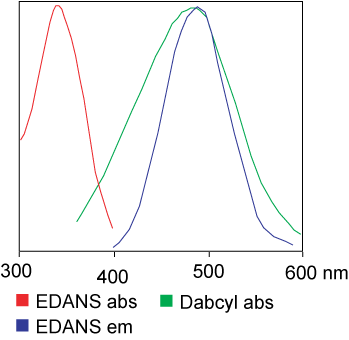
Фарбавальнік, які выкарыстоўваецца ў аналізе FRET, можа быць ідэнтычным.Але ў большасці выпадкаў на самай справе выкарыстоўваюцца розныя фарбавальнікі.Карацей кажучы, перадача энергіі светлавога рэзанансу - гэта перадача пары дыполяў ад донара (фарбавальнік 1) да акцэптара (фарбавальнік 2), калі група донараў узбуджана.У цэлым спектр выпраменьвання донарскай групы флюарафораў перакрываецца са спектрам паглынання акцэптарнай групы.«Калі адлегласць паміж двума флюарафораў адпаведная (10—100 А), можна назіраць перадачу энергіі флюарафора ад донара да акцэптара».Спосаб перадачы энергіі залежыць ад хімічнай структуры рэцэптара:
1. Ператвараецца ў малекулярную вібрацыю, гэта значыць святло перадачы энергіі знікае.(Рэцэптар - гэта гасіцель святла)
2. Выпраменьванне больш інтэнсіўнае, чым сам рэцэптар, што прыводзіць да чырвонага зрушэння ў другасным спектры флуарэсцэнцыі».(Рэцэптары - гэта выпраменьвальнікі святла).
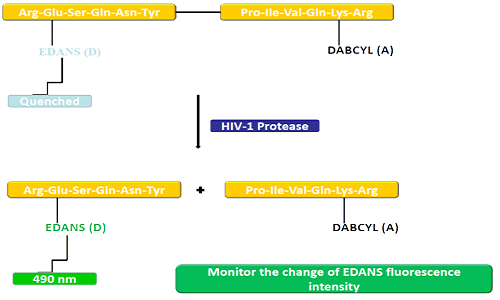
Донарская група (EDANS) і акцэптарны ген (DABCYL) раўнамерна звязаны з натуральным субстратам пратэазы ВІЧ, і калі субстрат не адключаны, DABCYL можа падушаць EDANS, а затым стаць невыяўным для фтору.Пасля адключэння пратэазы ВІЧ-1 EDANS больш не гасіцца DABCYL, і пасля гэтага можна выявіць люцыферазы EDANS.Даступнасць інгібітараў протеазы можна кантраляваць па зменах інтэнсіўнасці флуарэсцэнцыі EDANS.
Пептыды FRET з'яўляюцца зручным інструментам для вывучэння неспецыфічнасці пептыдазы.Паколькі працэс яго рэакцыі можна пастаянна кантраляваць, ён забяспечвае зручны метад выяўлення актыўнасці фермента.Бляск, які ўтвараецца пасля гідролізу пептыдных сувязяў донарам/акцэптарам, забяспечвае меру актыўнасці фермента пры нанамалярных канцэнтрацыях.Калі пептыд FRET непашкоджаны, ён дэманструе раптоўнае знікненне ўнутранай успышкі, але калі любая пептыдная сувязь насупраць донара/акцэптара разрываецца, яна вызваляе ўспышку, якую можна пастаянна выяўляць, і актыўнасць фермента можна вызначыць колькасна.
Час публікацыі: 14 жніўня 2023 г