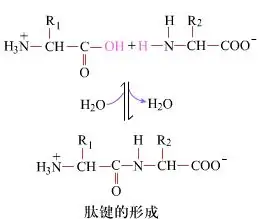
На паверхні ўтварэнне пептыдных сувязяў, якія атрымліваюць дыпептыды, з'яўляецца простым хімічным працэсам.Гэта азначае, што два амінакіслотныя кампаненты звязаны пептыднай сувяззю, аміднай сувяззю, у той час як абязводжваюцца.
Адукацыя пептыднай сувязі - гэта актывацыя амінакіслоты ў мяккіх умовах рэакцыі.(A) карбаксільны фрагмент, другая амінакіслата (B) Затым нуклеафільна актываваны карбаксільны фрагмент утварае дыпептыд (AB).«Калі карбаксільны кампанент (А) не абаронены, фарміраванне пептыднай сувязі немагчыма кантраляваць».Пабочныя прадукты, такія як лінейныя і цыклічныя пептыды, можна змешваць з мэтавымі злучэннямі АВ.Такім чынам, усе функцыянальныя групы, якія не ўдзельнічаюць у адукацыі пептыднай сувязі, павінны быць часова зварачальна абаронены падчас сінтэзу пептыдаў.
Такім чынам, сінтэз пептыдаў - адукацыя кожнай пептыднай сувязі - уключае ў сябе тры этапы агрэгацыі.
Першы крок заключаецца ў падрыхтоўцы некаторых амінакіслот, якія маюць патрэбу ў абароне, і цвітэр-іённая структура амінакіслот больш не існуе.
Другі этап - гэта двухэтапная рэакцыя адукацыі пептыдных сувязяў, у якой карбаксільная група N-абароненай амінакіслоты спачатку актывуецца да актыўнага прамежкавага прадукту, а затым утвараецца пептыдная сувязь.Гэтая спалучаная рэакцыя можа адбывацца альбо як рэакцыя ў адзін этап, альбо як дзве паслядоўныя рэакцыі.
Трэці этап - выбарачнае выдаленне або поўнае выдаленне ахоўнай асновы.Хоць усё выдаленне можа адбыцца толькі пасля зборкі ўсіх пептыдных ланцугоў, селектыўнае выдаленне ахоўных груп таксама неабходна для таго, каб працягнуць сінтэз пептыдаў.
Паколькі 10 амінакіслот (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec і Cys) утрымліваюць функцыянальныя групы бакавых ланцугоў, якія патрабуюць селектыўнай абароны, што ўскладняе сінтэз пептыдаў.Варта адрозніваць часовыя і паўпастаянныя ахоўныя базы з-за розных патрабаванняў да выбіральнасці.Часовыя ахоўныя групы выкарыстоўваюцца на наступным этапе, каб адлюстраваць часовую абарону амінакіслотных або карбаксільных функцыянальных груп.Полупостоянные ахоўныя групы выдаляюцца без умяшання ва ўжо сфармаваныя пептыдныя сувязі або бакавыя ланцугі амінакіслот, часам падчас сінтэзу.
«У ідэале актывацыя карбаксільнага кампанента і наступнае адукацыю пептыдных сувязяў (рэакцыі спалучэння) павінны адбывацца хутка, без утварэння рацэміі або пабочных прадуктаў, а для дасягнення высокіх выхадаў варта ўжываць малярныя рэагенты».На жаль, ні адзін з метадаў хімічнага спалучэння не задавальняе гэтым патрабаванням, і нешматлікія падыходзяць для практычнага сінтэзу.
Падчас сінтэзу пептыдаў функцыянальныя групы, якія ўдзельнічаюць у розных рэакцыях, звычайна звязаны з мануальным цэнтрам, адзіным выключэннем з'яўляецца гліцын, і існуе патэнцыйная рызыка ратацыі.
Апошнім этапам у цыкле сінтэзу пептыдаў з'яўляецца выдаленне ўсіх ахоўных груп.Выбарчае выдаленне ахоўных груп важна для падаўжэння пептыднага ланцуга ў дадатак да патрабавання поўнага выдалення абароны пры сінтэзе дыпептыдаў.Сінтэтычныя стратэгіі трэба старанна планаваць.У залежнасці ад стратэгічнага выбару N можа выбарачна выдаляць α-аміна або карбаксільныя ахоўныя групы.Тэрмін «стратэгія» адносіцца да паслядоўнасці рэакцый кандэнсацыі асобных амінакіслот.Увогуле, існуе розніца паміж паступовым сінтэзам і кандэнсацыяй фрагментаў.Сінтэз пептыдаў (таксама вядомы як «звычайны сінтэз») адбываецца ў растворы.У большасці выпадкаў паступовае падаўжэнне пептыднай ланцуга можа быць сінтэзавана толькі з выкарыстаннем пептыднай ланцуга для сінтэзу больш кароткіх фрагментаў.Каб сінтэзаваць больш доўгія пептыды, малекулы-мішэні неабходна сегментаваць на адпаведныя фрагменты і вызначыць, што яны могуць мінімізаваць ступень дыферэнцыяцыі на С-канцы.Пасля таго, як асобныя фрагменты будуць паступова сабраны, мэтавае злучэнне будзе злучана.Стратэгія сінтэзу пептыдаў уключае выбар найлепшага і найбольш прыдатнага ахоўнага фрагмента, а стратэгія сінтэзу пептыдаў уключае выбар найбольш прыдатнай камбінацыі ахоўных асноў і найлепшага метаду кан'югацыі фрагментаў.
Час публікацыі: 19 ліпеня 2023 г