Пептыды - гэта клас злучэнняў, якія ўтвараюцца злучэннем некалькіх амінакіслот праз пептыдныя сувязі.Яны паўсюдна сустракаюцца ў жывых арганізмах.Да цяперашняга часу ў жывых арганізмах знойдзены дзесяткі тысяч пептыдаў.Пептыды гуляюць важную ролю ў рэгуляцыі функцыянальнай дзейнасці розных сістэм, органаў, тканак і клетак, а таксама ў жыццядзейнасці і часта выкарыстоўваюцца ў функцыянальным аналізе, даследаванні антыцелаў, распрацоўцы лекаў і іншых галінах.З развіццём біятэхналогій і тэхналогіі сінтэзу пептыдаў, усё больш і больш пептыдных прэпаратаў былі распрацаваны і прымяняюцца ў клініцы.
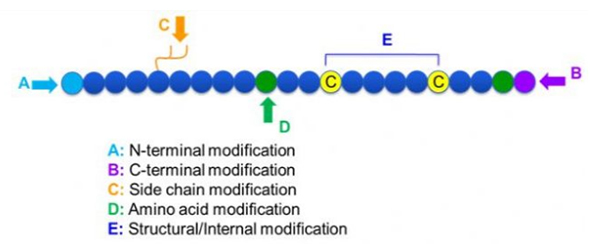
Існуе вялікая разнастайнасць мадыфікацый пептыдаў, якія можна проста падзяліць на пост-мадыфікацыю і мадыфікацыю працэсу (з выкарыстаннем мадыфікацыі атрыманых амінакіслот), а таксама мадыфікацыю N-канца, мадыфікацыю C-канца, мадыфікацыю бакавога ланцуга, мадыфікацыю амінакіслот, мадыфікацыю шкілета, і г.д., у залежнасці ад месца мадыфікацыі (малюнак 1).З'яўляючыся важным сродкам для змены структуры галоўнага ланцуга або груп бакавых ланцугоў пептыдных ланцугоў, мадыфікацыя пептыдаў можа эфектыўна змяняць фізічныя і хімічныя ўласцівасці пептыдных злучэнняў, павялічваць растваральнасць у вадзе, падаўжаць час дзеяння in vivo, змяняць іх біялагічнае размеркаванне, ліквідаваць імунагеннасць , паменшыць таксічныя пабочныя эфекты і г.д. У гэтым артыкуле прадстаўлены некалькі асноўных стратэгій мадыфікацыі пептыдаў і іх характарыстыкі.
1. Цыклізацыя
Цыклічныя пептыды маюць шмат прымянення ў біямедыцыне, і многія прыродныя пептыды з біялагічнай актыўнасцю з'яўляюцца цыклічнымі пептыдамі.Паколькі цыклічныя пептыды, як правіла, больш жорсткія, чым лінейныя, яны надзвычай устойлівыя да стрававальнай сістэмы, могуць выжываць у стрававальным тракце і праяўляюць больш моцнае сродство да мэтавых рэцэптараў.Цыклізацыя - самы прамы спосаб сінтэзу цыклічных пептыдаў, асабліва для пептыдаў з вялікім структурным шкілетам.У адпаведнасці з рэжымам цыклізацыі яго можна падзяліць на тып бакавой ланцуга - бакавы ланцуг, тэрмінал - тып бакавой ланцуга, тэрмінал - тэрмінальны тып (тып ад канца да канца).
(1) сайдчэйн-да-сайдчэйну
Найбольш распаўсюджаным тыпам цыклізацыі бакавой ланцуга да бакавой ланцуга з'яўляецца дысульфіднае перамыканне паміж рэшткамі цыстэіну.Гэтая цыклізацыя ўводзіцца шляхам зняцця абароны з пары рэшткаў цыстэіну, якія затым акісляюцца з адукацыяй дысульфідных сувязяў.Поліцыклічны сінтэз можа быць дасягнуты селектыўным выдаленнем сульфгідрыльных ахоўных груп.Цыклізацыя можа праводзіцца альбо ў растваральніку пасля дысацыяцыі, альбо на смале перад дысацыяцыяй.Цыклізацыя на смолах можа быць менш эфектыўнай, чым цыклізацыя ў растваральніку, таму што пептыды на смолах не лёгка ўтвараюць цыкліфікаваныя канфармацыі.Іншы тып бакавой ланцуга - цыклізацыя бакавога ланцуга - гэта адукацыя аміднай структуры паміж астаткам аспарагінавай або глутамінавай кіслаты і асноўнай амінакіслатой, што патрабуе магчымасці селектыўнага выдалення ахоўнай групы бакавога ланцуга з поліпептыду альбо на смале або пасля дысацыяцыі.Трэці тып бакавой ланцуга - цыклізацыя бакавой ланцуга - гэта адукацыя дифениловых эфіраў тыразіну або п-гидроксифенилглицином.Гэты тып цыклізацыі ў натуральных прадуктах сустракаецца толькі ў мікробных прадуктах, і прадукты цыклізацыі часта маюць патэнцыйнае медыцынскае значэнне.Атрыманне гэтых злучэнняў патрабуе унікальных умоў рэакцыі, таму яны не часта выкарыстоўваюцца ў сінтэзе звычайных пептыдаў.
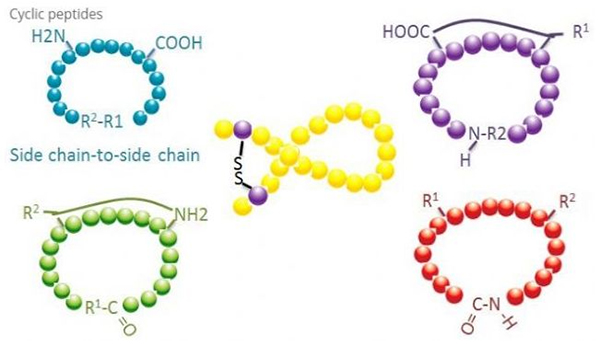
(2) тэрмінал да бакавой ланцугу
Цыклізацыя канцавой бакавой ланцуга звычайна ўключае С-канец з амінагрупай бакавога ланцуга лізіну або арніціну або N-канец з бакавым ланцугом аспарагінавай або глутамінавай кіслаты.Іншая цыклізацыя поліпептыдаў адбываецца шляхам утварэння эфірных сувязяў паміж канцом С і бакавымі ланцугамі серыну або трэаніну.
(3) Тэрмінальны або галава-хвост тыпу
Ланцуговыя поліпептыды могуць быць цыклічна ў растваральніку або замацаваны на смале шляхам цыкліравання бакавога ланцуга.Нізкія канцэнтрацыі пептыдаў варта выкарыстоўваць пры цэнтралізацыі растваральніка, каб пазбегнуць алігамерызацыі пептыдаў.Выхад поліпептыда сінтэтычнага кольца ад галавы да хваста залежыць ад паслядоўнасці поліпептыда ланцуга.Такім чынам, перш чым рыхтаваць цыклічныя пептыды ў вялікім маштабе, спачатку трэба стварыць бібліятэку магчымых звязаных свінцовых пептыдаў з наступнай цыклізацыяй, каб знайсці паслядоўнасць з лепшымі вынікамі.
2. N-метилирование
N-метыляванне першапачаткова адбываецца ў натуральных пептыдах і ўводзіцца ў сінтэз пептыдаў, каб прадухіліць адукацыю вадародных сувязяў, тым самым робячы пептыды больш устойлівымі да біяраскладання і ачыстцы.Сінтэз пептыдаў з выкарыстаннем вытворных N-метилированных амінакіслот - найважнейшы метад.Акрамя таго, можа быць выкарыстана рэакцыя Міцунобу N-(2-нітрабензолсульфонілхларыд) поліпептыд-смалы прамежкавых прадуктаў з метанолам.Гэты метад быў выкарыстаны для падрыхтоўкі бібліятэк цыклічных пептыдаў, якія змяшчаюць N-метилированные амінакіслоты.
3. Фасфараляванне
Фасфараляванне - адна з найбольш распаўсюджаных у прыродзе посттрансляцыйных мадыфікацый.У клетках чалавека фасфарылявана больш за 30% бялкоў.Фасфараляванне, асабліва зварачальнае фасфараляванне, гуляе важную ролю ў кантролі многіх клеткавых працэсаў, такіх як перадача сігналу, экспрэсія генаў, клеткавы цыкл і рэгуляцыя цыташкілета, а таксама апоптоз.
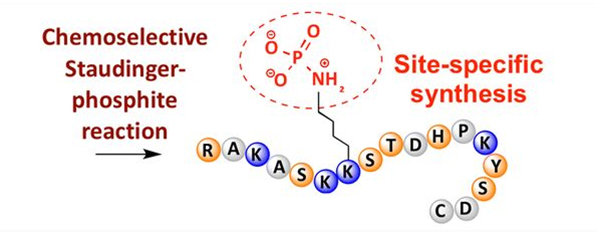
Фасфараляванне можна назіраць у розных амінакіслотных астатках, але найбольш распаўсюджанымі мішэнямі фасфаралявання з'яўляюцца рэшткі серыну, трэаніну і тыразіну.Вытворныя фосфатыразіну, фосфатрэаніну і фосфасерыну могуць быць уведзены ў пептыды падчас сінтэзу або ўтварыцца пасля сінтэзу пептыдаў.Селектыўнае фасфараляванне можа быць дасягнута з дапамогай рэшткаў серыну, трэаніну і тыразіну, якія выбарачна выдаляюць ахоўныя групы.Некаторыя рэагенты фасфаралявання могуць таксама ўводзіць групы фосфарнай кіслаты ў поліпептыд шляхам постмадыфікацыі.У апошнія гады сайт-спецыфічнае фасфараляванне лізіну было дасягнута з дапамогай хімічна селектыўнай рэакцыі Штаудінгера-фасфіту (малюнак 3).
4. Миристоилирование і пальмитоилирование
Ацыляванне N-канца тоўстымі кіслотамі дазваляе пептыдам або вавёркам звязвацца з клеткавымі мембранамі.Миридамоилированная паслядоўнасць на N-канцы дазваляе нацэльваць протеинкиназы сямейства Src і вавёркі Gaq зваротнай транскрыптазы для звязвання з клеткавымі мембранамі.Миристиновая кіслата была звязана з N-канцам поліпептыда смалы з дапамогай стандартных рэакцый спалучэння, і атрыманы ліпапептыд можна было раз'яднаць у стандартных умовах і ачысціць з дапамогай RP-HPLC.
5. Гликозилирование
Глікапептыды, такія як ванкаміцын і тэйкаланін, з'яўляюцца важнымі антыбіётыкамі для лячэння ўстойлівых да лекаў бактэрыяльных інфекцый, а іншыя глікапептыды часта выкарыстоўваюцца для стымуляцыі імуннай сістэмы.Акрамя таго, так як многія мікробныя антыгены гликозилированы, вялікае значэнне мае вывучэнне гликопептидов для паляпшэння тэрапеўтычнага эфекту інфекцыі.З іншага боку, было выяўлена, што вавёркі на клеткавай мембране опухолевых клетак дэманструюць анамальнае гліказіляванне, што прымушае глікапептыды гуляць важную ролю ў даследаваннях імуннай абароны рака і пухлін.Глікапептыды атрымліваюць метадам Fmoc/t-Bu.Гліказіляваныя рэшткі, такія як трэанін і серын, часта ўводзяцца ў поліпептыды fMOCs, актываванымі пентафторфенольным эфірам, для абароны гліказіляваных амінакіслот.
6. Ізапрэн
Изопентадиенилирование адбываецца на рэштках цистеина ў бакавой ланцугу каля С-канца.Бялковы ізапрэн можа палепшыць сродство клеткавай мембраны і ўтварыць бялковае бялковае ўзаемадзеянне.Изопентадиенированные вавёркі ўключаюць тыразін-фасфатазу, малую ГТазу, малекулы кохаперона, ядзерную пласцінку і цэнтрамерныя звязваюць вавёркі.Поліпептыды изопрена могуць быць атрыманы з выкарыстаннем ізапрэну на смолах або шляхам увядзення вытворных цистеина.
7. Мадыфікацыя поліэтыленгліколя (ПЭГ).
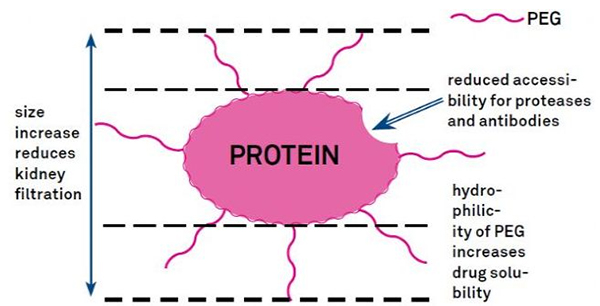
Мадыфікацыя PEG можа быць выкарыстана для паляпшэння гідралітычнай стабільнасці бялку, біяразмеркавання і растваральнасці пептыдаў.Увядзенне ланцугоў ПЭГ у пептыды можа палепшыць іх фармакалагічныя ўласцівасці, а таксама інгібіраваць гідроліз пептыдаў пратэялітычных ферментаў.ПЭГ-пептыды праходзяць праз капілярны клубочак лягчэй, чым звычайныя пептыды, значна зніжаючы нырачны кліранс.З-за падоўжанага актыўнага перыяду паўраспаду пептыдаў ПЭГ in vivo нармальны ўзровень лячэння можна падтрымліваць меншымі дозамі і менш частымі пептыднымі прэпаратамі.Аднак мадыфікацыя PEG таксама мае негатыўныя наступствы.Вялікая колькасць ПЭГ перашкаджае ферменту разбураць пептыд, а таксама зніжае звязванне пептыда з рэцэптарам-мішэнню.Але нізкае сродства ПЭГ-пептыдаў звычайна кампенсуецца іх больш доўгім фармакокинетическим перыядам паўраспаду, і, знаходзячыся ў арганізме даўжэй, ПЭГ-пептыды маюць большую верагоднасць усмоктвання ў тканіны-мішэні.Такім чынам, спецыфікацыі палімера ПЭГ павінны быць аптымізаваны для атрымання аптымальных вынікаў.З іншага боку, пептыды ПЭГ назапашваюцца ў печані з-за зніжэння нырачнага кліранс, што прыводзіць да макрамалекулярнага сіндрому.Такім чынам, мадыфікацыі PEG павінны быць распрацаваны больш старанна, калі пептыды выкарыстоўваюцца для тэставання лекаў.
Агульныя мадыфікацыйныя групы мадыфікатараў ПЭГ можна прыблізна абагульніць наступным чынам: аміна (-амін) -NH2, амінаметыл-Ch2-NH2, гідраксі-OH, карбаксі-Cooh, сульфгідрыл (-тыол) -SH, малеімід -MAL, сукцынімід карбанат - SC, сукцынімід ацэтат -SCM, сукцынімід прапіёнат -SPA, n-гідраксісукцынімід -NHS, акрылат-ch2ch2cooh, альдэгід -CHO (такі як прапіёналь-альд, бутырALD), акрылавая аснова (-акрылат-acrl), азіда-азід, біятыніл - Біятын, флуарэсцеін, глутарыл -GA, акрылатгідразід, алкін-алкін, п-талуолсульфанат -OTs, сукцынімід сукцынат -SS і г.д. Вытворныя ПЭГ з карбонавымі кіслотамі могуць быць звязаны з n-канцавымі амінамі або бакавымі ланцугамі лізіну.ПЭГ, актываваны амінакісамі, можа быць злучаны з бакавымі ланцугамі аспарагінавай або глутамінавай кіслаты.Дрэнна актываваны ПЭГ можа быць кан'югаваны з меркаптанам з цалкам знятай абаронай бакавых ланцугоў цыстэіну [11].ПЭГ-мадыфікатары звычайна класіфікуюцца наступным чынам (заўвага: mПЭГ - гэта метокси-ПЭГ, CH3O-(CH2CH2O)n-CH2CH2-OH):
(1) мадыфікатар PEG з прамой ланцугом
mPEG-SC, mPEG-SCM, mPEG-SPA, mPEG-OTs, mPEG-SH, mPEG-ALD, mPEG-butyrALD, mPEG-SS
(2) біфункцыянальны мадыфікатар PEG
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCl·NH2-PEG-COOH, MAL-PEG-NHS
(3) разгалінаванне PEG мадыфікатар
(mPEG)2-NHS, (mPEG)2-ALD, (mPEG)2-NH2, (mPEG)2-MAL
8. Біятынізацыя
Біятын можа быць моцна звязаны з авідынам або стрэптавідынам, і сіла звязвання нават блізкая да кавалентнай сувязі.Пептыды, пазначаныя біятынам, звычайна выкарыстоўваюцца ў імунааналізе, гістацытахіміі і флуарэсцэнтнай праточнай цытаметрыі.Пазначаныя антыцелы да антыбіётыкаў таксама можна выкарыстоўваць для звязвання біятыніляваных пептыдаў.Біятынавыя этыкеткі часта прымацоўваюцца да бакавой ланцуга лізіну або N-канца.6-амінакапронавая кіслата часта выкарыстоўваецца ў якасці сувязі паміж пептыдамі і біятынам.Сувязь гнуткая ў звязванні з падкладкай і лепш звязваецца пры наяўнасці стэрычных перашкод.
9. Флуарэсцэнтная маркіроўка
Флуарэсцэнтная маркіроўка можа быць выкарыстана для адсочвання поліпептыдаў у жывых клетках і для вывучэння ферментаў і механізмаў дзеяння.Трыптафан (Trp) з'яўляецца флуоресцентным, таму яго можна выкарыстоўваць для ўласнай маркіроўкі.Спектр выпраменьвання трыптафану залежыць ад перыферыйнага асяроддзя і памяншаецца з памяншэннем палярнасці растваральніка, уласцівасць, карысная для выяўлення структуры пептыдаў і звязвання з рэцэптарамі.Флуарэсцэнцыю трыптафану можна патушыць пратанаванай аспарагінавай і глутамінавай кіслатой, што можа абмежаваць яго выкарыстанне.Хларыдная група Dansil (Dansyl) моцна флуарэсцэнтная, калі звязана з амінагрупай, і часта выкарыстоўваецца ў якасці флуарэсцэнтнай пазнакі для амінакіслот або бялкоў.
Флуарэсцэнтнае рэзананснае пераўтварэнне энергіі (FRET) карысна для даследаванняў ферментаў.Пры ўжыванні FRET поліпептыд-субстрат звычайна змяшчае групу для маркіроўкі флуарэсцэнцыі і групу для гашэння флуарэсцэнцыі.Пазначаныя флуоресцентные групы гасяцца тушыцелем шляхам нефатоннай перадачы энергіі.Калі пептыд адлучаецца ад разгляданага фермента, група маркіроўкі выпраменьвае флуарэсцэнцыю.
10. Поліпептыды клеткі
Пептыды клеткі маюць аптычна выдаляемыя ахоўныя групы, якія абараняюць пептыд ад звязвання з рэцэптарам.Пры ўздзеянні УФ-выпраменьвання пептыда актывуецца, аднаўляючы сваё сродство да рэцэптара.Паколькі гэтую аптычную актывацыю можна кантраляваць у залежнасці ад часу, амплітуды або месцазнаходжання, пептыды клеткі можна выкарыстоўваць для вывучэння рэакцый, якія адбываюцца ў клетках.Найбольш часта выкарыстоўваюцца ахоўныя групы для поліпептыдаў клеткі - гэта 2-нітрабензільныя групы і іх вытворныя, якія могуць быць уведзены ў сінтэзе пептыдаў праз ахоўныя вытворныя амінакіслот.Вытворныя амінакіслот, якія былі распрацаваны, - гэта лізін, цыстэін, серын і тыразін.Аднак вытворныя аспартата і глутамата звычайна не выкарыстоўваюцца з-за іх успрымальнасці да цыклізацыі падчас сінтэзу і дысацыяцыі пептыдаў.
11. Поліантыгенны пептыд (MAP)
Кароткія пептыды звычайна не маюць імунітэту і павінны быць звязаны з вавёркамі-носьбітамі для выпрацоўкі антыцелаў.Поліантыгенны пептыд (MAP) складаецца з некалькіх аднолькавых пептыдаў, звязаных з ядрамі лізіну, якія могуць спецыфічна экспрэсаваць імунагены з высокай патэнцыяй і могуць быць выкарыстаны для падрыхтоўкі куплетаў бялок-носьбіт пептыд.Поліпептыды MAP можна сінтэзаваць шляхам цвёрдафазнага сінтэзу на смале MAP.Аднак няпоўнае спалучэнне прыводзіць да таго, што на некаторых галінах пептыдныя ланцугі адсутнічаюць або ўсечаюцца, і, такім чынам, ён не праяўляе ўласцівасцей зыходнага поліпептыда MAP.У якасці альтэрнатывы пептыды можна прыгатаваць і ачысціць асобна, а затым злучыць з MAP.Пептыдная паслядоўнасць, прымацаваная да пептыднага ядра, добра вызначаецца і лёгка характарызуецца з дапамогай мас-спектраметрыі.
Заключэнне
Мадыфікацыя пептыдаў з'яўляецца важным сродкам распрацоўкі пептыдаў.Хімічна мадыфікаваныя пептыды могуць не толькі падтрымліваць высокую біялагічную актыўнасць, але і эфектыўна пазбягаць недахопаў імунагеннасці і таксічнасці.У той жа час хімічная мадыфікацыя можа надзяліць пептыды новымі выдатнымі ўласцівасцямі.У апошнія гады метад актывацыі СН для постмадыфікацыі поліпептыдаў быў хутка распрацаваны, і было дасягнута шмат важных вынікаў.
Час публікацыі: 20 сакавіка 2023 г
